ما هي الكيمياء الذرية؟ دليل شامل لفهم بنية الذرة وأسرارها
كل شيء من حولنا، من الهواء الذي نتنفسه إلى النجوم البعيدة في السماء، يتكون من وحدات بناء أساسية ومجهرية تُعرف بالذرات. في الواقع، العلم الذي يغوص في أعماق هذه الوحدات ليكشف أسرارها ويفسر سلوكها هو الكيمياء الذرية. فهي ليست مجرد فرع من فروع الكيمياء، بل هي الأساس الذي تقوم عليه كل العلوم المادية. لذلك، في هذا الدليل الشامل، سننطلق في رحلة إلى قلب المادة، لنفهم بنية الذرة، ونتعرف على تاريخ اكتشافها، ونكتشف كيف أن هذا العالم الصغير يحكم كل شيء في عالمنا الكبير.
ما هي الذرة؟ أصغر وحدة بناء في الكون
الذرة هي أصغر جزء من العنصر الكيميائي يمكن أن يوجد ويحتفظ بالخصائص الكيميائية لذلك العنصر. ولكن، المثير للدهشة هو أن الذرة معظمها فراغ! حيث تتكون من نواة صغيرة جدًا وكثيفة للغاية في المركز، محاطة بسحابة واسعة من الإلكترونات التي تدور حولها بسرعات هائلة. لفهم حجم هذا الفراغ، تخيل أن النواة بحجم حبة بازلاء في وسط ملعب كرة قدم؛ فإن الإلكترونات ستكون تدور في المدرجات.
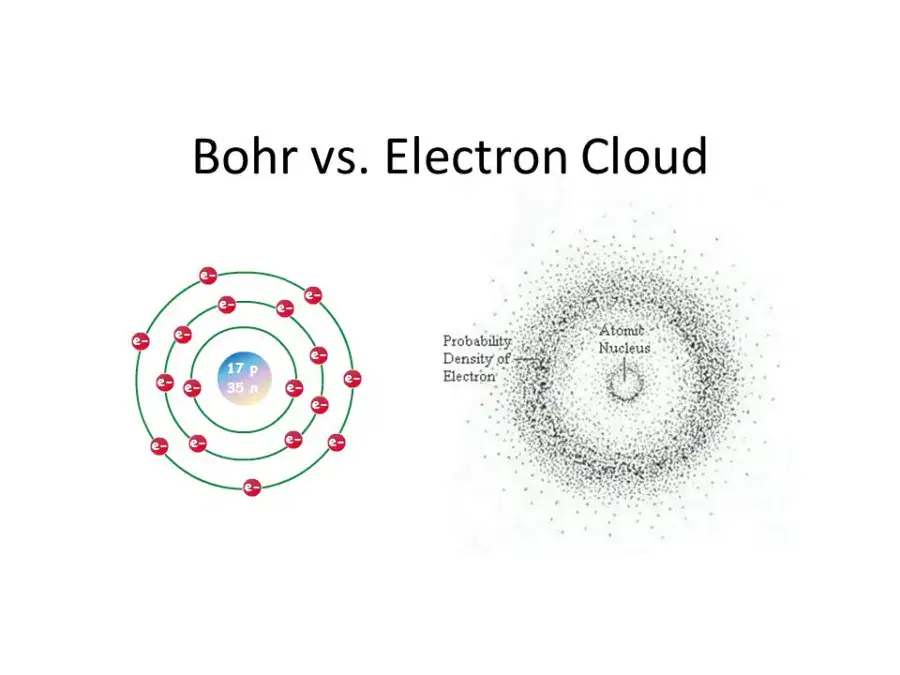
رحلة عبر التاريخ: تطور النظرية الذرية
إن فهمنا الحالي للذرة هو نتاج قرون من البحث والاكتشافات التي قام بها عدد من أعظم العقول في تاريخ العلم.
- نموذج دالتون (أوائل القرن التاسع عشر): اقترح العالم جون دالتون أن الذرات هي كرات مصمتة وغير قابلة للتجزئة، مثل كرات البلياردو.
- نموذج طومسون (1897): بعد اكتشافه للإلكترون، اقترح ج. ج. طومسون أن الذرة هي كرة موجبة الشحنة تتوزع فيها الإلكترونات السالبة، مثل الزبيب في كعكة.
- نموذج رذرفورد (1911): من خلال تجربته الشهيرة لرقائق الذهب، أثبت إرنست رذرفورد أن معظم كتلة الذرة وشحنتها الموجبة تتركز في مركز صغير جدًا أسماه “النواة”.
- نموذج بور (1913): اقترح نيلز بور أن الإلكترونات لا تدور بشكل عشوائي، بل في مدارات أو مستويات طاقة ثابتة حول النواة، مثل الكواكب حول الشمس.
- النموذج الكمي الحديث: أظهرت ميكانيكا الكم أننا لا نستطيع تحديد موقع الإلكترون بدقة. بل يمكننا فقط تحديد منطقة يحتمل وجوده فيها تُعرف بـ “السحابة الإلكترونية” أو “المدار الذري”. هذا هو النموذج الأكثر دقة الذي نستخدمه اليوم وهو أساس الكيمياء الذرية الحديثة.
تشريح الذرة: مكونات الذرة الأساسية
تتكون كل ذرة من ثلاثة أنواع من الجسيمات دون الذرية:
1. النواة (The Nucleus)
هي مركز الذرة الثقيل والموجب الشحنة، وتتكون من:
- البروتونات: جسيمات موجبة الشحنة. عدد البروتونات (العدد الذري) هو الذي يحدد هوية العنصر. على سبيل المثال، أي ذرة تحتوي على 6 بروتونات هي ذرة كربون.
- النيوترونات: جسيمات متعادلة الشحنة. تعمل على استقرار النواة.
2. سحابة الإلكترونات (The Electron Cloud)
هي المنطقة الشاسعة حول النواة التي توجد فيها الإلكترونات.
- الإلكترونات: هي جسيمات سالبة الشحنة وخفيفة جدًا. إن طريقة توزيع الإلكترونات في مداراتها، وخاصة الإلكترونات الموجودة في المدار الخارجي (إلكترونات التكافؤ)، هي التي تحدد السلوك الكيميائي للذرة وكيفية تفاعلها مع الذرات الأخرى.
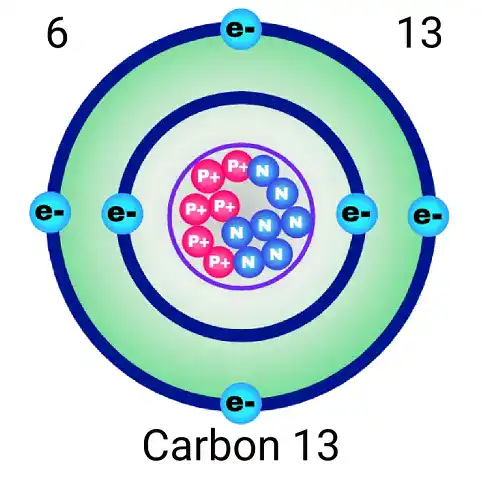
النظائر المشعة: نسخ مختلفة من نفس العنصر
النظائر هي ذرات لنفس العنصر تحتوي على نفس عدد البروتونات ولكن بأعداد مختلفة من النيوترونات. على سبيل المثال، معظم ذرات الكربون في الطبيعة هي كربون-12 (6 بروتونات و 6 نيوترونات). لكن هناك نظيرًا نادرًا هو كربون-14 (6 بروتونات و 8 نيوترونات). هذا النظير غير مستقر ومشبع، وتستخدم خاصية تحلله الإشعاعي في تأريخ الحفريات والآثار القديمة. إن دراسة النظائر جزء أساسي من الكيمياء الذرية ولها تطبيقات هائلة في الطب والطاقة.
جدول ملخص لأهم مفاهيم الكيمياء الذرية
| المفهوم | الشرح | الأهمية |
|---|---|---|
| مكونات الذرة | يجيب سؤال ما هي مكونات الذرة بأنها البروتونات والنيوترونات في النواة، والإلكترونات في السحابة المحيطة. | هي الوحدات الأساسية التي تبني كل المادة في الكون. |
| تطور النموذج الذري | يُظهر تطور النموذج الذري كيف انتقل فهمنا من كرة مصمتة إلى نموذج كمي معقد. | يعكس قصة التقدم العلمي في الفيزياء والكيمياء. |
| الجدول الدوري | يقدم شرح الجدول الدوري للعناصر كيف يتم ترتيب العناصر بناءً على عدد بروتوناتها وتركيبها الإلكتروني. | هو الأداة التنظيمية الأساسية في علم الكيمياء. |
| الروابط الكيميائية | توضح أنواع الروابط الكيميائية (الأيونية والتساهمية) كيف تتحد الذرات لتكوين الجزيئات والمركبات. | هي القوة التي تربط العالم المادي معًا. |
كيف تتفاعل الذرات؟ سر الروابط الكيميائية
إن الهدف الأساسي لمعظم الذرات هو الوصول إلى حالة من الاستقرار. وهي تحقق ذلك من خلال تكوين روابط كيميائية مع ذرات أخرى عن طريق إلكتروناتها الخارجية (إلكترونات التكافؤ).
- الرابطة الأيونية: تحدث عندما “تسرق” ذرة إلكترونًا من ذرة أخرى. الذرة التي تفقد إلكترونًا تصبح موجبة الشحنة، والتي تكتسبه تصبح سالبة الشحنة، فتتجاذبان معًا. (مثال: ملح الطعام NaCl).
- الرابطة التساهمية: تحدث عندما “تتشارك” ذرتان أو أكثر في الإلكترونات لتحقيق الاستقرار. (مثال: جزيء الماء H₂O).
إن فهم هذه الروابط هو جوهر الكيمياء بأكملها، وهو يبدأ من فهم بنية الذرة.
تطبيقات الكيمياء الذرية في عالمنا
إن فهمنا للذرة ليس مجرد معرفة نظرية، بل له تطبيقات عملية غيرت عالمنا:
- الطاقة النووية: تعتمد على انشطار نواة ذرات اليورانيوم لإطلاق كميات هائلة من الطاقة.
- الطب النووي: تُستخدم النظائر المشعة في تشخيص الأمراض (مثل التصوير المقطعي بالإصدار البوزيتروني PET) وفي علاج السرطان (العلاج الإشعاعي).
- الإلكترونيات: تعتمد صناعة أشباه الموصلات، التي هي أساس كل الأجهزة الإلكترونية، على فهم دقيق لكيفية سلوك الإلكترونات في ذرات السيليكون.
- علم المواد: يسمح لنا فهم التركيب الذري بتصميم مواد جديدة بخصائص فريدة، من السبائك فائقة القوة إلى البوليمرات المتقدمة.
من الذرة إلى الكون
في الختام، إن الكيمياء الذرية هي المدخل لفهم كل شيء مادي من حولنا. من أصغر خلية في أجسامنا إلى أبعد مجرة في الكون، كل شيء محكوم بقوانين الذرة وسلوك مكوناتها. إنها قصة مذهلة عن كيف أن أبسط الوحدات يمكن أن تتحد لتشكل التعقيد المذهل للوجود. وكلما تعمقنا في أسرار الذرة، تعمق فهمنا لمكانتنا في هذا الكون الواسع.
من الصفر.. كيف تتعلَّم الكيمياء ببساطة؟
اقرأ في مقالنا عن:
- ما هي الكيمياء الحيوية؟ دليل شامل لفهم كيمياء الحياة
- الهندسة الوراثية البشرية: علاج الأمراض أم بداية الأطفال المصممين
- ما هي الكيمياء التحليلية؟ دليل شامل لتعريفها وتطبيقاتها اليومية
- ما هي الكيمياء الفيزيائية؟ دليل شامل لفهم فروعها وتطبيقاتها
- ما هو القانون العلمي؟ أمثلة مبسطة على أشهر القوانين العلمية
- أقطاب المغناطيس: شرح مبسط لماذا تتجاذب الأقطاب وتتنافر
الذرة: بنيتها الداخلية، خصائصها التعريفية، وتفاعلاتها الكيميائية